Manual de coproanalisis para asistentes de laboratorio clinico
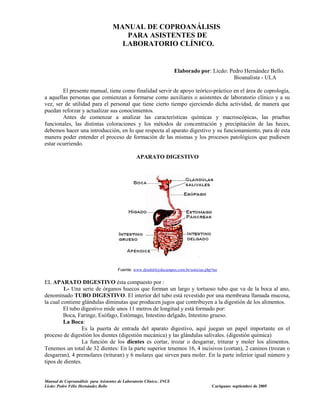
- 1. MANUAL DE COPROANÁLISIS PARA ASISTENTES DE LABORATORIO CLÍNICO. Elaborado por: Licdo: Pedro Hernández Bello. Bioanalista - ULA El presente manual, tiene como finalidad servir de apoyo teórico-práctico en el área de coprología, a aquellas personas que comienzan a formarse como auxiliares o asistentes de laboratorio clínico y a su vez, ser de utilidad para el personal que tiene cierto tiempo ejerciendo dicha actividad, de manera que puedan reforzar y actualizar sus conocimientos. Antes de comenzar a analizar las características químicas y macroscópicas, las pruebas funcionales, las distintas coloraciones y los métodos de concentración y precipitación de las heces, debemos hacer una introducción, en lo que respecta al aparato digestivo y su funcionamiento, para de esta manera poder entender el proceso de formación de las mismas y los procesos patológicos que pudiesen estar ocurriendo. APARATO DIGESTIVO Fuente: www.drashirleydecampos.com.br/noticias.php?no EL APARATO DIGESTIVO ésta compuesto por : 1.- Una serie de órganos huecos que forman un largo y tortuoso tubo que va de la boca al ano, denominado TUBO DIGESTIVO. El interior del tubo está revestido por una membrana llamada mucosa, la cual contiene glándulas diminutas que producen jugos que contribuyen a la digestión de los alimentos. El tubo digestivo mide unos 11 metros de longitud y está formado por: Boca, Faringe, Esófago, Estómago, Intestino delgado, Intestino grueso. La Boca: Es la puerta de entrada del aparato digestivo, aquí juegan un papel importante en el proceso de digestión los dientes (digestión mecánica) y las glándulas salivales. (digestión química) La función de los dientes es cortar, trozar o desgarrar, triturar y moler los alimentos. Tenemos un total de 32 dientes: En la parte superior tenemos 16, 4 incisivos (cortan), 2 caninos (trozan o desgarran), 4 premolares (trituran) y 6 molares que sirven para moler. En la parte inferior igual número y tipos de dientes. Manual de Coproanálisis para Asistentes de Laboratorio Clínico.. INCE Licdo: Pedro Félix Hernández Bello Carúpano: septiembre de 2005
- 2. Fuente: http--icarito_tercera_cl-infografia-chumano-digestivo-img-min-ano_gif.htm La lengua se halla cubierta por la membrana lingual, especializada en ciertos lugares para detectar el sabor de los alimentos y contribuye a mezclar la saliva con los alimentos que están siendo triturados por los dientes.. Unas pequeñas estructuras sensoriales (alrededor de diez mil) llamadas papilas gustativas nos permiten disfrutar de las sensaciones del gusto y, algo muy importante, nos avisan si los alimentos están en mal estado y no debemos comerlos. Sólo podemos percibir cuatro diferentes sabores, agrio, salado, amargo, y dulce, porque las papilas gustativas sólo tienen esa función. Fuente: www.drashirleydecampos.com.br/noticias.php?no La parte delantera de la lengua se usa para los sabores dulces como el azúcar y la miel. Las partes laterales de la lengua saborean las cosas agrias como los limones o el vinagre. Las papilas gustativas en la parte posterior de tu lengua saborean las cosas amargas como la cáscara de un pomelo o de un plátano. Las papilas gustativas que saborean las cosas saladas están por todas partes de la lengua. Podemos saborear la sal en todas partes del cuerpo. Los componentes químicos de la comida que ingerimos, estimulan a los receptores de cada una de estas zonas y los nervios trasmiten estos impulsos al cerebro. El sentido del olfato añade información para conseguir una amplia gama de sabores http://www.sedl.org/scimath/pasopartners/senses/SPlesson6.html Manual de Coproanálisis para Asistentes de Laboratorio Clínico.. INCE Licdo: Pedro Félix Hernández Bello Carúpano: septiembre de 2005
- 3. En la cavidad bucal desembocan las glándulas salivales, que secretan la saliva, la cuál está formada, en un 95 por ciento por agua, y el 5 por ciento restante por sustancias disueltas en agua, tales como iones sodio, potasio, cloruro, bicarbonato y fosfatos. Posee además una sustancia formada por suero llamada mucus y dos enzimas que son la amilasa salival y la lisozima. La s funciones de la saliva son: • Actuar como lubricante. • Destruir parte de las bacterias ingeridas con los alimentos. • Comenzar la digestión química de los glúcidos mediante una enzima -proteína que acelera un cambio químico- llamada amilasa o ptialina, la cual cataliza el almidón (hidrato de carbono presente en los vegetales) y lo transforma en maltosa, un tipo de azúcar que se produce como consecuencia de esta degradación. La saliva también nos ayuda a saborear la comida. Al poner un dulce sobre la lengua no se siente el gusto de inmediato, ya que necesitamos mojar el dulce con la saliva, masticarlo, y mezclarlo con más saliva antes de poder saborearlo. La saliva se mezcla con la comida y distribuye los sabores a todas partes de la lengua. Existen tres pares de glándulas productoras de saliva: las parótidas, las sublinguales y las submaxilares. La saliva contiene la enzima amilasa, que facilita la masticación, el sabor y la deglución. Fuente:http.icarito_latercera_cl-infografia-chumano-digestivo03-img-glandulas_salivales_jpg.htm La Faringe La faringe es un tubo musculoso situado en el cuello y revestido de membrana mucosa; conecta la nariz y la boca con la tráquea y el esófago. Por la faringe pasan tanto el aire como los alimentos. En el hombre mide unos trece centímetros, ubicándose delante de la columna vertebral. Como arranca de la parte posterior de la cavidad nasal, su extremo más alto se llama nasofaringe. La inferior, u orofaringe, ocupa la zona posterior de la boca. Termina en la epiglotis, un pliegue cartilaginoso que impide la entrada de alimentos en la tráquea, pero no obstaculiza su paso al esófago. Para que las vías respiratorias permanezcan cerradas durante la deglución (o acción de tragar), la epiglotis obstruye la glotis para impedir que el alimento se introduzca en el sistema respiratorio. Manual de Coproanálisis para Asistentes de Laboratorio Clínico.. INCE Licdo: Pedro Félix Hernández Bello Carúpano: septiembre de 2005
- 4. Fuente: http--icarito_tercera_cl-infografia-chumano-digestivo-img-min-ano_gif .htm El Esófago: Es un conducto músculo membranoso que se extiende desde la parte inferior de la faringe hasta el extremo superior del estómago. El esófago comienza en el cuello, atraviesa todo el tórax y pasa al abdomen a través del hiato esofágico del diafragma. Tiene una longitud que oscila entre los 23 y los 25 centímetros, siendo su principal función la de transportar el alimento hacia el estómago. Habitualmente es una cavidad virtual (es decir que sus paredes se encuentran unidas y sólo se abren cuando pasa el bolo alimenticio). De los dientes incisivos al cardias (porción donde el esófago se continúa con el estómago) hay aprox. 40 cm. El bolo toca el esófago y lo estimula y así comienza. El esófago esta pegado y va empujando al bolo y estos son los movimientos peristáltico, además éste siempre esta húmedo y así facilita el paso del alimento. Fuente: www.nlm.nih.gov/.../ ency/esp_imagepages/8871.htm Fuente: www_webciencia_com-11_22peristal_jpg_archivos11_22digestao.htm El Estómago: El estómago es un saco hueco y elástico con forma de J, siendo la parte más ancha del tubo digestivo. Está situado en la cavidad abdominal, bajo el hígado, al costado izquierdo del cuerpo. Consta de varias partes que son: fundus, cuerpo y antro. Presenta una curvatura menor (borde menos extenso) y una curvatura mayor. Mide aprox. 25 cm del cardias al píloro y el diámetro transverso es de 12 cm. El cardias es el límite entre el esófago y el estómago y el píloro es el límite entre el estómago y el duodeno. Manual de Coproanálisis para Asistentes de Laboratorio Clínico.. INCE Licdo: Pedro Félix Hernández Bello Carúpano: septiembre de 2005
- 5. El cardias da paso al bolo alimenticio desde el esófago al estómago y se cierra para impedir que retroceda. El píloro se abre para permitir el paso de la masa alimenticia del estómago al intestino delgado y se cierra para impedir su retroceso. Las paredes del estómago son musculosas, y su elasticidad les permite ensancharse cuando es necesario almacenar una gran cantidad de alimento. Los músculos del estómago son muy potentes y producen un movimiento ondulatorio que hace que los alimentos se mezclen con los jugos gástricos secretados por las glándulas que existen en sus paredes; así los alimentos que antes eran sólidos se transforman lentamente en una masa líquida y espesa llamada quimo. Las glándulas gástricas de células principales, producen pepsinógeno y las parietales, secretan ácido clorhídrico. http://www.araucaria2000.cl/cuerpohumano/cuerpohumano.htm El Intestino Delgado: Situado en la cavidad abdominal, el intestino delgado es un tubo alargado y hueco con paredes más delgadas que las del estómago. Su función primaria es la digestión y absorción de los alimentos y otras sustancias. Se divide en tres partes: duodeno, o parte más cercana al estómago; yeyuno, o porción media; e íleon, tramo final. Mide entre siete y nueve metros de largo, plegado varias veces y su calibre disminuye progresivamente desde su origen (en el píloro) hasta la válvula ileocecal por la que se une a la primera parte del intestino grueso. Al igual que el estómago, el intestino delgado tiene músculos que, al moverse, hacen que los alimentos vayan avanzando. La pared interior del intestino delgado no es lisa, sino que presenta una gran cantidad de vellosidades intestinales, que aumentan la superficie de absorción intestinal y están irrigadas internamente por pequeños vasos sanguíneos y de los nutrientes al cual son transferidos los nutrientes. Fuente: http--icarito_latercera_cl-infografia-chumano-digestivo03-img-Intestino_delgado_jpg.htm El duodeno: mide entre 25 – 30 cm. de largo, consta de una parte próxima o yeyuno y una parte distal o íleon, el límite entre estas dos porciones no es muy apreciable. El duodeno se une al yeyuno después de los 30 cm. a partir del píloro. En este nivel actúan las enzimas pancreáticas: lipasa, amilasa, tripsina y quimiotripsina. La digestión del quimo ocurre predominantemente en el duodeno y en Manual de Coproanálisis para Asistentes de Laboratorio Clínico.. INCE Licdo: Pedro Félix Hernández Bello Carúpano: septiembre de 2005
- 6. las primeras porciones del yeyuno. En el duodeno también actúa el jugo pancreático y la secreción biliar (sales y ácidos biliares). http--superfund_pharmacy_arizona_edu-toxamb-images-f1-1-3-a_jpg.htm El yeyuno-íleon: es una parte del intestino delgado que se caracteriza por presentar unos extremos relativamente fijos: El primero se origina en el duodeno y el segundo se limita a la válvula ileocecal y primera porción del ciego. Su calibre disminuye progresivamente en dirección al intestino grueso. Las vellosidades intestinales se localizan en las células epiteliales del intestino son extensiones de aproximadamente 0.5-1.5 mm, en forma de dedos, cuya función es incrementar el área de la superficie de contacto y por lo tanto, aumentar la superficie de absorción. Estas vellosidades son más anchas en el duodeno que en el resto del intestino. La presencia del vello es primordial para la función óptima del intestino delgado. La superficie de absorción se hace aún más grande por medio de pequeños cepillos que cubren el vello intestinal y a los cuales se denominan microvellos. Los microvellos están cubiertos por membranas que los protegen contra agentes proteolíticos y mucolíticos. Cualquier tóxico que altere la estructura morfológica del vello y microvello afectará la absorción, y por lo tanto ocasionará una posible desnutrición al disminuir la absorción de proteínas, minerales esenciales y otros nutrientes. Fuente:http://www.araucaria2000.cl/cuerpohumano/cuerpohumano.htm Manual de Coproanálisis para Asistentes de Laboratorio Clínico.. INCE Licdo: Pedro Félix Hernández Bello Carúpano: septiembre de 2005
- 7. Fuente: http://www.araucaria2000.cl/cuerpohumano/cuerpohumano.htm Fuente: http://www.araucaria2000.cl/cuerpohumano/cuerpohumano.htm El intestino delgado secreta ciertas enzimas, como la Maltasa, Sucrasa y la Lactasa, que se encargan de convertir los disacáridos a monosacáridos y la Peptidasa que divide los grandes péptidos a pequeños y luego en aminoácidos individuales, también secreta la hormona secretina, que estimula al páncreas para producir las enzimas digestivas. El Intestino Grueso: Se inicia a partir de la válvula ileocecal (costado inferior derecho de nuestro cuerpo) en un fondo de saco denominado ciego de dónde sale el apéndice vermiforme y termina en el recto. Desde el ciego al recto describe una serie de curvas, formando un marco en cuyo centro están las asas del yeyuno-íleon. Su longitud varía entre 120 y 160 cm. y su calibre disminuye progresivamente, siendo la parte más estrecha la región donde se une con el recto, donde el diámetro por lo general no sobrepasa los 3 cm., mientras que el ciego es de 6 o 7 cm. Fuente: http://www.araucaria2000.cl/cuerpohumano/cuerpohumano.htm Manual de Coproanálisis para Asistentes de Laboratorio Clínico.. INCE Licdo: Pedro Félix Hernández Bello Carúpano: septiembre de 2005
- 8. Después del ciego, encontramos la segunda porción del intestino grueso, denominada colon ascendente, (mide aprox. 15 cm de longitud), para dar origen a la tercera porción o colon transverso (aprox. 50 cm. de longitud), originándose una cuarta porción o colon descendente (aprox. 10 cm. de longitud). Por último se diferencia el colon sigmoide y el recto. Ciertas sustancias que forman los alimentos son absorbidas por el torrente sanguíneo a nivel del intestino delgado. El resto de lo consumido pasa al intestino grueso, conocido también como colon, lugar donde se produce la absorción del agua que ingresa al sistema: circulatorio. Al perder esa masa semi líquida el agua que llegó al intestino grueso se transforma en una más sólida. El recto es la parte terminal del tubo digestivo y termina abriéndose al exterior por el orificio anal o ano. Fuente: www.nlm.nih.gov/.../ ency/esp_imagepages/8832.htm El recto forma parte del intestino grueso y está situado a continuación del mismo. Su forma es cilíndrica, excepto en su parte inferior, llamada ampolla. La parte terminal del intestino o recto mide unos 15 centímetros de longitud y debe este nombre a su forma casi recta. La salida del recto se llama ano. Posee una longitud de trece centímetros y está cerrada por un músculo que lo rodea, el esfínter anal. En su interior presenta dos especies de válvulas (válvulas de Houston), una de las cuales (válvula de Kohlrausch) es bastante visible en el lado derecho. En su parte inferior hay una serie de repliegues curvilíneos, denominadas válvulas semilunares de Morgagni, separadas entre sí por las columnas del mismo nombre. Por debajo del recto está el canal anal, de unos cuatro centímetros de longitud, revestido de crestas verticales llamadas columnas anales. En las paredes del canal anal hay dos fuertes hojas planas de músculos, llamados esfínteres (interno y externo), que actúan como válvulas y que se relajan durante la defecación. Fuente: http--icarito_tercera_cl-infografia-chumano-digestivo-img-min-ano_gif .htm Manual de Coproanálisis para Asistentes de Laboratorio Clínico.. INCE Licdo: Pedro Félix Hernández Bello Carúpano: septiembre de 2005
- 9. 2.- Dos órganos compactos, el HÍGADO y el PÁNCREAS, que producen jugos que llegan al intestino a través de pequeños tubos. El hígado es la mayor víscera del cuerpo pesa alrededor de 1.500 gramos. Consta de dos lóbulos. Las vías biliares son las vías excretoras del hígado, por ellas la bilis es conducida al duodeno; normalmente salen dos conductos: derecho e izquierdo, que confluyen entre sí formando un conducto único, el conducto hepático, recibe un conducto mas fino, el conducto cístico, que proviene de la vesícula biliar alojada en la cara visceral del hígado. De la reunión de los conductos císticos y el hepático se forma el colédoco, que desciende al duodeno, en la que desemboca junto con el conducto excretor del páncreas. La vesícula biliar es un saco excretor, en forma de pera que mide aprox. 8 cm. de longitud y sirve como reservorio de bilis, contiene alrededor de 50 ml de bilis. Fuente: www_cirugia_net-imagenes-fotos-6_jpg.htm El Páncreas: Es una glándula estrechamente relacionada con el duodeno, el conducto excretor del páncreas, que termina reuniéndose con el colédoco a través de la ampolla de Vater. Secreta enzimas importantes en la digestión de los alimentos. La lipasa pancreática: descompone las grasas en glicerol y ácidos grasos. La Amilasa: descompone el almidón en Maltosa. La Tripsina y la Quimiotripsina: dividen las proteínas en Polipéptidos y Péptidos. Fuente: http://www.araucaria2000.cl/cuerpohumano/cuerpohumano.htm 3.- Algunos componentes de otros aparatos y sistemas juegan un papel importante en el aparato digestivo. Por ejemplo: hormonas y nervios Manual de Coproanálisis para Asistentes de Laboratorio Clínico.. INCE Licdo: Pedro Félix Hernández Bello Carúpano: septiembre de 2005
- 10. Hormonas: Las principales hormonas que controlan las funciones del aparato digestivo se producen y liberan a partir de células de la mucosa gástrica y del intestino delgado, y se denominan Gastrina, Secretina y Colecistonina. La Gastrina hace que el estómago produzca un ácido que disuelve y digiere algunos alimentos. Es necesaria también para el crecimiento normal de la mucosa gástrica, el intestino delgado y el colon. La Secretina hace que el páncreas secrete un jugo digestivo rico en bicarbonato. Estimula al estómago para que produzca pepsina, una enzima que digiere las proteínas y al hígado para que produzca bilis. La Colecistocinina hace que el páncreas crezca y produzca las enzimas del jugo pancreático y hace que la vesícula biliar se vacíe. Los nervios: Dos clases de nervios ayudan a controlar el trabajo del aparato digestivo. Los nervios extrínsecos llegan a los órganos digestivos desde el cerebro o desde la medula espinal y provocan la liberación de dos sustancias químicas: la acetilcolina y la adrenalina. La acetilcolina hace que los músculos de los órganos digestivos se contraigan con mas fuerza y empujen mejor los alimentos y líquidos a través del sistema digestivo. También estimula al estómago y al páncreas para que produzcan mas jugos. La adrenalina relaja el músculo del estómago y de los intestinos y disminuye el flujo de sangre que llega hasta los órganos. Los nervios intrínsecos (forman una red en las paredes del esófago, estómago, intestino delgado, y colon) son aún más importantes. La acción de estos nervios se desencadena cuando las paredes de los órganos huecos se estiran con la presencia de los alimentos. Liberan muchas sustancias diferentes que aceleran o retrasan el movimiento de los alimentos y la producción de jugos en los órganos digestivos. Fuente: http://www.araucaria2000.cl/cuerpohumano/cuerpohumano.htm Manual de Coproanálisis para Asistentes de Laboratorio Clínico.. INCE Licdo: Pedro Félix Hernández Bello Carúpano: septiembre de 2005
- 11. LA DIGESTIÓN Los alimentos son las cosas que nos metemos en la boca y los nutrientes son los alimentos transformados en moléculas más sencillas. El proceso digestivo comienza en la boca, los alimentos son cubiertos por la saliva (digestión química) triturados y divididos por la acción de la masticación (digestión mecánica) y una vez formado el bolo, ocurre la deglución o sea que el alimento en forma de bola pasa fácilmente al esófago, en dónde se producen movimientos peristálticos, que gracias al tejido muscular liso, hacen que el alimento baje al estómago en dónde son reducidos a una masa semifluida de consistencia uniforme denominada quimo, que atraviesa al píloro a intervalos y luego penetra al duodeno, dónde es transformado por las secreciones del páncreas, intestino delgado e hígado, continuándose su digestión y absorción, hasta llegar al intestino grueso. La válvula ileocecal obstaculiza el vaciamiento demasiado rápido del intestino delgado e impide el reflujo del contenido del intestino grueso al intestino delgado. La principal función del intestino grueso es la formación, transporte y evacuación de las heces. Una función muy importante es la absorción de agua. En el ciego y el colon ascendente las materias fecales son casi líquidas y es allí donde se absorbe la mayor cantidad de agua y algunas sustancia disueltas, pero aun en regiones mas distales (recto y colon sigmoideo) se absorben líquidos. Las heces permanecen en el colon hasta el momento de la defecación. Fuente: www_profesorenlinea_cl-quinto-imagenes5b-apadiges_jpg.htm Formación de desechos y defecación . Aunque las materias que llegan al colon han perdido mucha parte de sus componentes, el conjunto todavía es líquido. Cierta cantidad de agua es absorbida en el intestino delgado, aproximadamente la equivalente a la aportada por la bilis y el jugo pancreático. La principal función del colon es absorber agua y reducir los desechos a consistencia semisólida. En el colon se producen también movimientos peristálticos, aunque de frecuencia más lenta. Cada cierto tiempo, los movimientos peristálticos más enérgicos impelen las materias hacia el recto, siendo más frecuentes después de haber comido, debido a un mecanismo reflejo por el cual la contracción del estómago estimula el vaciamiento del colon. La defecación en parte es voluntaria, debido a la contracción de los músculos de la pared abdominal, del diafragma y a la relajación del esfínter externo del ano, y en parte involuntaria, dependiente de la relajación del esfínter interno del ano y de la contracción del intestino grueso y el recto, Manual de Coproanálisis para Asistentes de Laboratorio Clínico.. INCE Licdo: Pedro Félix Hernández Bello Carúpano: septiembre de 2005
- 12. que impulsan las heces hacia el ano. La distensión del recto y el estímulo resultante de los nervios de sus paredes es lo que despierta el deseo de defecar. Las alteraciones patológicas de la digestión pueden conllevar a situaciones de diarrea o estreñimiento Diarrea La diarrea es un padecimiento bien conocido por todos los médicos y sufrido por casi todas las personas. La diarrea es una enfermedad gastrointestinal que se manifiesta con un aumento en el número y cantidad de deposiciones al día, cuyo contenido de agua es mayor de lo normal, tomando las características de "flojas, aguadas o líquidas".El número de deposiciones varía según al dieta y la edad, pero en general se define la diarrea como tres o más deposiciones líquidas o blandas por día. Puede ser aguda o crónica y es siempre la consecuencia de malabsorcion de agua y electrolitos La diarrea crónica se presenta cuando las heces frecuentes o sueltas persisten durante más de dos semanas. Es una manifestación de muy diversas enfermedades, tanto digestivas como de otros aparatos y sistemas. De las digestivas es más frecuente por afección del yeyuno-íleon y del colon. El mecanismo productor de la diarrea es el desequilibrio entre la secreción y absorción de líquidos en el intestino, así como el aumento del tránsito intestinal, todo ello por causas bacterianas, virales, tóxicas, inflamatorias, neurógenas, hormonales, nerviosos, irritativos, degenerativos, etc. Se debe recordar que en el tubo digestivo se vierten diariamente en los adultos 7 litros de diversas secreciones, como saliva, jugo gástrico, jugo pancreático, bilis, jugo duodenal y secreción intestinal. Todo este enorme volumen es normalmente reabsorbido en el yeyuno y en el íleon y un poco menos de 1 litro en el colon y sólo de 100ml a 200ml se eliminan diariamente con las evacuaciones. Las heces normales son en volumen entre 70% y 80% agua, pero tienen forma y consistencia normales y basta 20% más de agua para que se conviertan en heces totalmente líquidas. La diarrea infecciosa está originada por la colonización y multiplicación de microorganismos a nivel del tubo digestivo, los que actúan por mecanismos: invasivo, toxigénico, o mixto. Una variedad de agentes pueden ser los responsables: virus, bacterias, parásitos y hongos; algunos conocidos desde épocas pasadas y otros recientemente. Es posible que la lista continúe ampliándose en el futuro. CLASIFICACION Diarrea osmótica.- se produce cuando persiste en el intestino un exceso de solutos hidrosolubles no absorbibles que retienen agua en la luz. Esto ocurre con la intolerancia a la lactosa y a otros azúcares o por el uso de laxantes. Es frecuente luego de la administración de medio de contraste oral para la realización de una TAC. Estas heces presentan un ph Ácido, por lo general ≤ 5,5. Diarrea secretora.- se produce cuando el intestino delgado y el grueso secretan agua y electrolitos en vez de absorberlos. Entre estas tenemos: las toxinas bacterianas (la bacteria del cólera) enteroproteus, los virus, parásitos, hongos también denominada diarrea infecciosa y la producida por los ácidos biliares, los catárticos, aceite de ricino, algunos fármacos. El pH es alcalino ≥ 8,5 Diarrea exudativa.- La inflamación, la ulceración y la tumefacción de la mucosa como por ejemplo la enteritis regional, colitis ulcerativa, linfoma y carcinoma , pueden originar el vertido de plasma, suero, proteínas, sangre y moco a la luz, con lo que aumenta el volumen y la fluidez de las heces. Es consecuencia de infecciones bacterianas (Salmonella), clostridium difficile (frecuentemente inducidos por antibióticos) parásitos del colon (Entamoeba histolytica), enfermedad de Crohn, enterocolitis por radiación e isquemia intestinal, proctocolitis ulcerativa y enfermedad intestinal inflamatoria idiopática. Diarrea motora. Aunque poco estudiada, se sabe con certeza que se producen alteraciones hiperperistálticas con disminución en el contacto entre el contenido luminal y la mucosa intestinal. A Manual de Coproanálisis para Asistentes de Laboratorio Clínico.. INCE Licdo: Pedro Félix Hernández Bello Carúpano: septiembre de 2005
- 13. menudo la diarrea es intermitente y alterna con estreñimiento. Es causada por diabetes mellitus, hipertiroidismo y, también por el síndrome de intestino irritable. Alteración del tránsito intestinal.- Reducción de la superficie de absorción. Algunas operaciones (resección o derivación intestinal amplia) dejan una superficie de absorción inadecuada para líquidos y electrolitos. Es el denominado síndrome de intestino corto. ETIOLOGÍA • Diarrea infecciosa o Bacteriana: Salmonella, Shigella, Campylobacter fetus, Vibrio cholerae, Escherichia coli enteropatogénica (ECEP), Clostridium, Yersinia enterocolitica, Vibrio parahemolyticus. o Vírica: enterovirus, virus asociado de la hepatitis, agentes tipo parvovirus, orbivirus, citomegalovirus, rotavirus (niños). o Micótica: Candida, Actinomyces, Histoplasma. o Protozoos: Giarda lamblia, Entamoeba histolytica. o Helmintos: Ascaris lumbricoides, Ancylostoma duodenale, Necator americanus, Trichuris trichiura, Strongyloides stercoralis. o • toxinas. o Intoxicación por alimentos: estafilococos, Clostridium perfringens, E. coli toxicógeno, Clostridium botulinum, Bacillus cereus, Clostridium difficile, Pseudomonas. o Diarrea del viajero-ECET (esc. coli enterotoxigénica) o Tóxicos químicos: arsénico, plomo, mercurio • alimentos o Alimentos irritantes o aditivos alimenticios o alcohol o alergias alimentarias o alactasia (diarrea osmótica muy frecuente por déficit de lactasa) o intolerancia alimentaria no especifica o sustitutos del azúcar no absorbibles (sorbitol, manitol). • farmacos o laxantes o diuréticos o teofilina o colirios colinérgicos para el glaucoma o antibióticos o citostáticos • Otras causas. o Apendicitis, o diverticulitis, o impactacion fecal (seudodiarrea) o hemorragia gastrointestinal, o colitis isquémica. o radioterapia o quimioterapia Estreñimiento: Es la dificultad en la eliminación de las heces, o emisión incompleta e infrecuente de heces anormalmente duras. Obedece a múltiples causas tanto orgánicas como funcionales. Algunas causas Manual de Coproanálisis para Asistentes de Laboratorio Clínico.. INCE Licdo: Pedro Félix Hernández Bello Carúpano: septiembre de 2005
- 14. orgánicas son la obstrucción intestinal, la diverticulitis y tumores. En personas ancianas o encamadas que no pueden satisfacer satisfactoriamente la necesidad de defecar puede aparecer un trastorno funcional de colon. La frecuencia es variable en cada persona y por ello se puede hablar de estreñimiento si se producen menos de tres evacuaciones intestinales por semana. El número de evacuaciones que presenta un bebé recién nacido depende de su alimentación (más evacuaciones y más líquidas, en los alimentados sólo con leche materna, con respecto a los bebés alimentados con fórmulas adaptadas). En general, un bebé de menos de 6 meses debe de evacuar no menos de una vez al día y tener tres deposiciones semanales después de esta de edad. Para los 2 años de edad los niños pueden tener entre una y dos evacuaciones por día. El estreñimiento agudo puede aparecer en cualquier persona en un momento concreto por situaciones de cambios en los hábitos normales. Es muy frecuente en los cambios de alimentación, viajes, ciertos medicamentos, a veces por nerviosismo, o sin más por falta de rutina transitoria en la evacuación, y el embarazo. ¿Qué causa el estreñimiento? A medida que el alimento pasa por la vía digestiva, su cuerpo absorbe los nutrientes y el agua de los alimentos. Este proceso crea la materia fecal que se mueve a través de sus intestinos por medio de los movimientos peristálticos. Varias cosas pueden afectar este proceso. Éstas incluyen, no beber suficientes líquidos, no estar lo suficientemente activo, no comer suficiente fibra, estar tomando ciertos medicamentos, no ir al baño cuando se sienta necesidad de defecar y el uso regular de laxantes. ¿Cuál es la relación entre el estreñimiento y la incontinencia de heces? Los niños que tienen problemas con estreñimiento pueden también ensuciar su ropa interior con heces, ya que como no vacían por completo sus intestinos, guardan mucha cantidad de heces dentro del recto y cuando hay demasiado, estas escapan por el ano. Heces La palabra Copro es un prefijo que significa “heces “o “relativo a las heces”. Por lo tanto, coproanálisis sería definido etimológicamente, como análisis de heces; coprocultivo, como cultivos de heces; coprófago(ga) (fago = comer, ingerir) que se alimenta de excrementos, coprolitos ( litos = piedra) excrementos fosilizados etc.. Las heces están constituidas por productos alimenticios no digeribles y no digeridos, como secreciones mucosas y celulosa, restos de jugos intestinales procedentes de hígado, páncreas y otras glándulas digestivas; enzimas no destruidas, leucocitos, células epiteliales, restos procedentes de las paredes intestinales, glóbulos de grasa, productos nitrogenados procedentes de proteínas; sales minerales, agua y grandes cantidades de bacterias. La tercera parte del peso de la heces está constituida por bacterias, cuya mayor parte y a veces todas no son patógenas.. En heces patológicas podemos encontrar dependiendo de la patología, moco, pus, sangre y restos de tejidos. En las enfermedades donde está alterada la digestión y en las acompañadas de diarrea, se hallan en gran cantidad los restos alimenticios, porque el tránsito por el intestino se ha efectuado antes de completarse la digestión y la absorción. (tránsito global rápido). Muchos de estos residuos alimenticios se pueden identificar macroscópicamente ( a simple vista), como por ejemplo: semillas, cortezas o pieles de frutas y verduras, etc.. ó microscópicamente (con ayuda del microscopio) cómo las fibras musculares, las células vegetales, fibras, pelos, etc… La cantidad de heces está determinada en gran parte por la cantidad y el carácter de los alimentos y por el volumen de agua ingerido. Una dieta vegetal aumenta la cantidad de heces (aprox. 350 gr/día ó más) debido a que la fibra vegetal es de difícil digestión y con una dieta rica en carnes se eliminan aprox. 60 gr/ día. Lo normal para un adulto son entre 100 y 200 gr/ día. En diarreas agudas graves pueden eliminarse hasta varios litros diarios. En enfermedades gastrointestinales (G.I) se examina la materia fecal, con la finalidad de detectar hemorragia gastrointestinal, ictericia obstructiva, parasitosis, disentería, colitis ulcerativa y excreción de grasa anormal, además que permite estudiar enfermedades que se acompañan de diarrea o constipación. Manual de Coproanálisis para Asistentes de Laboratorio Clínico.. INCE Licdo: Pedro Félix Hernández Bello Carúpano: septiembre de 2005
- 15. CARACTERISTICAS DE LAS HECES PESO MEDIO POR DIA 250 ( 100-400) gr. PESO HECES DESECADAS 65 gr pH 7-7,5 AGUA 75% peso total SODIO 35 mEq/l POTASIO 75 mEq/l CLORO 73 mEq/l CALCIO 70-600 mg/24 h UROBILINÓGENO 40-280 mg/24 h ESTERCOBILINA hasta 250 mg/ dia NITROGENO FECAL < 2 gr/dia GRASA FECAL MEDIA 5 gr/dia COPROPORFIRINAS 100-400 µg/24 h ¿Cuando hacer un análisis de heces? Aparte de las situaciones agudas que nos obliguen a su realización, lo haremos, Cuando: 1.- Si tienen picor en el ano (prurito anal). 2,- Si tienen dolor abdominal persistente. 3.- Si tiene períodos intermitentes de diarrea. 4.- Elevación de Eosinófilos en sangre Recolección de la muestra: Bebes y niños pequeños: Si los niños usan pañales, se puede cubrir el pañal con un envoltorio plástico, si usan pañales desechables, se debe colocar el pañal en forma incorrecta (con la parte plástica hacia el niño) para prevenir que el pañal absorba los parásitos y bacterias que estamos intentando buscar, en ambos casos, transferir la muestra a un recipiente recolector para heces. En algunos casos se puede valer de un escobillón o un termómetro para estimular el reflejo de defecación al introducirlo cuidadosamente a través del orificio anal. Niños que no usan pañales y adultos: Se puede recoger las heces con la ayuda de un envoltorio plástico que se coloca suelto sobre la poceta y se sostiene en su lugar con el asiento. También con el envoltorio plástico podemos forrar internamente el “vaso de cama”. Luego se transfiere una parte de la muestra a un recipiente recolector para heces. Nunca recoja la muestra de heces del agua de la poceta o del vaso de cama. Si su niño orina al mismo tiempo no recoja estas heces. Las muestras de heces obtenidas deben enviarse inmediatamente al laboratorio, especialmente si son líquidas o semilíquidas ya que los trofozoítos pierden movilidad y mueren poco después de enfriarse la muestra. Si se van a determinar azúcares reductores, la muestra no debe tardar en llegar al laboratorio más de 20 minutos, ya que las bacterias desdoblan los azucares. Al llegar la muestra al laboratorio, lo primero que se debe hacer, es identificarla correctamente y tomar en cuenta el tipo de análisis ordenado, ya que algunos ameritan rapidez en su ejecución, después de recolectada la muestra Manual de Coproanálisis para Asistentes de Laboratorio Clínico.. INCE Licdo: Pedro Félix Hernández Bello Carúpano: septiembre de 2005
- 16. En el análisis coprológico se estudian las distintas características de la materia fecal con fines diagnósticos. ASPECTO: Según el aspecto las heces pueden ser: 1.- HOMOGENEAS. 2.- HETEROGENEAS 1.- HOMOGÉNEAS: Cuando no hay diferenciación entre los componentes que constituyen la muestra. Ejemplo: heces con características similares a productos achocolatados tipo NUCITA® (sólo sirva esto como ejemplo gráfico) 2.- HETEROGÉNEAS: La mayoría de las heces son heterogéneas, en este tipo de muestra observamos diferenciación de textura entre los diferentes elementos que componen la muestra. Ejemplo: heces con semillas, restos cárnicos, restos vegetales, fibras, moco etc… No debe haber fibras de carnes en las heces normales, su presencia puede indicar que hubo digestión mecánica incompleta, (masticación inadecuada) o está alterada la digestión intraluminal, (deficiencia de tripsina o síndrome de mala absorción) ésta se correlaciona con el contenido de grasa en las heces COLOR La primera vez que los recién nacidos vacían su intestino excretan unas deposiciones negras, espesas y pegajosas, llamadas meconio. El intestino del recién nacido no se mueve mientras permanece intraútero por lo que se produce un acúmulo de bilis que, al oxidarse, dan a las heces este aspecto tan característico. Suelen expulsarlo durante las primeras 24 horas de vida, gracias a la acción laxante del calostro, lo cual ayuda a eliminar la bilirrubina y a evitar la ictericia. Al pasar los días, las heces se tornan verdosas y posteriormente amarillas. El color de las heces está asociado al tipo de alimentación, los nuevos alimentos modifican la flora intestinal. Normalmente las heces son de color pardo ó marrón en distintas tonalidades, debido principalmente a la presencia de estercobilina, la cuál es producto de la degradación de la bilirrubina y ésta a su vez de la hemoglobina. Al romperse el glóbulo rojo se libera la hemoglobina, la cual es transformada en el plasma en bilirrubina indirecta, ésta se conjuga en el hígado con el ácido glucurónico, convirtiéndose en bilirrubina conjugada o directa, se excreta por el hígado a traves del conducto biliar, pasa al intestino delgado y es transformada por la acción bacteriana en estercobilinógeno, su variante oxidada la estercobilina se pierde con las heces y es su principal pigmento. En el caso de la orina reciben el nombre de urobilinógeno y urobilina. El color de las heces también va a depender del tipo de alimentación del individuo, la ingestión de fármacos (medicamentos) y a la presencia de trastornos gastrointestinales COLORACIONES PATOLÓGICAS: 1. HECES AMARILLAS: • Individuos sometidos a régimen lácteo. Ejemplo: niños lactantes • Tránsito acelerado del intestino delgado: Diarreas: Esteatorrea del sprue. Insuficiencia pancreática. • Inflamaciones • Tuberculosis intestinal. • Influencia medicamentosa Ruibarbo. Sen. Santonina. Manual de Coproanálisis para Asistentes de Laboratorio Clínico.. INCE Licdo: Pedro Félix Hernández Bello Carúpano: septiembre de 2005
- 17. 2.- HECES VERDES: • Influencia de la alimentación (alimentos ricos en clorofila como: espinacas, brócoli, perejil etc.… • Influencia de medicamentos (calomelanos) • Infecciones instaladas después de antibioticoterapia. Ejemplo: bacilo piociánico. • Diarreas de tipo duodenal (diarrea yeyunal). • En recién nacidos (meconio) relacionado con la excreción de biliverdina y porfirina. 3.- HECES GRISÁCEAS O BLANCO-GRISÁCEAS (ACÓLICAS) • Esteatorreas de diversos orígenes. • Obstrucción de vías biliares. (debido a la ausencia de estercobilina en la Ictericia Obstructiva). • Solución de contraste radiográfico (Solución de Bario). 4.- HECES PARDO OSCURO: • Dieta rica en proteína animal. 5.- HECES ROJAS: • Ingesta de remolacha, moras, uvas, cerezas rojas , tomates etc.. • Hemorragia del tracto digestivo inferior. 6.- HECES NEGRAS: (similar al petróleo). • Ingesta de morcilla, vino tinto, sangre digerida. • Medicamentos: Hierro, nicotina, ácido oxálico, fósforo, mercurio. • Hemorragia digestiva superior (melenas). CONSISTENCIA La consistencia de las heces va a depender principalmente de la ingesta de agua, tipo de alimentación y del o los procesos patológicos que puedan estar ocurriendo. En el recién nacido deposiciones muy líquidas o con mucosidades sugieren una irritación del tracto digestivo. Normalmente las heces deben ser cilíndricas y con buena consistencia (bien formadas) para que al ser excretadas mantengan esta forma. Las heces blandas sugieren transito rápido; heces pequeñas y duras sugieren transito lento. Éste parámetro nos puede orientar incluso a la fase en la cual podemos observar a los protozoarios; si es la fase vegetativa o trofozoíto, por lo general los encontramos en heces líquidas., semilíquidas o blandas, mientras que los quistes en heces duras, pastosas, blandas y rara vez en heces líquidas o semilíquidas. Los helmintos, larvas , huevos, proglótides podemos encontrarlos en cualquier tipo de muestra. Desde el punto de vista de la consistencia podemos clasificar a las heces en: HECES LÍQUIDAS: pueden verterse con facilidad y no existen elementos sólidos en la misma. HECES SEMILÍQUIDAS: parecida a la anterior pero con elementos sólidos o semisólidos. HECES BLANDAS: carecen de forma al igual que las anteriores pero contienen un mayor porcentaje de elementos sólidos o semisólidos. HECES PASTOSAS: se diferencian de las blandas porque están formadas y pueden puncionarse con el aplicador. Manual de Coproanálisis para Asistentes de Laboratorio Clínico.. INCE Licdo: Pedro Félix Hernández Bello Carúpano: septiembre de 2005
- 18. HECES DURAS: poseen menor contenido de agua que las pastosas, están formadas y presentan resistencia al tratar de puncionarlas con el aplicador. Fuente:http://images.google.es/imgres? imgurl=http://www.bondisalud.com.ar/1%2520heces.jpg&imgrefurl=http://www.bondisalud.com.ar/105.html&h=306&w=386&s z=29&tbnid=Xog_MuTvIu8J:&tbnh=94&tbnw=118&start=1&prev=/images%3Fq%3D%2Bheces%26hl%3Des%26lr%3D OLOR El olor es causado por ciertos productos aromáticos originados en el intestino, mediante procesos de fermentación o putrefacción que actúan sobre hidratos de carbono y proteínas. La imposibilidad de estandarización de éste parámetro a permitido excluirlo de los reportes y en la actualidad un muy alto porcentaje de laboratorios no lo utilizan. La experiencia en el área nos permite sugerir ciertas cosas, por ejemplo: a.- heces blandas inodoras: diarrea de origen nervioso o deposiciones de niños de pecho. b.- heces con sangre y moco, inodoras: Shigellosis. c.- olor muy fétido con reacción alcalina,: putrefacción en la parte izquierda del colon. d.- olor ácido (agrio o rancio): presencia de azúcares reductores, sobre todo si el pH ≤ 5,5. REACCIÓN: El pH de la materia fecal depende de la dieta y de factores endógenos, una alimentación rica en proteínas determina alcalinidad, mientras que la abundancia de carbohidratos produce acidez. En otras palabras, el rango de pH Normal es neutral (que es ligeramente alcalino o ácido). El pH aumenta cuando hay degradación de las proteínas, y disminuye en casos de malabsorcion de grasas y azúcares. Los lactantes tienen heces ligeramente ácidas, los que toman leche no materna, poseen un pH neutral o ligeramente alcalino. Anormalmente, la reacción es ácida en trastornos digestivos con predominio de los procesos de fermentación y alcalina en aquellos con predomino de procesos de putrefacción. Si las heces no presentan otras características patológicas se pueden considerar como normal, heces ligeramente ácidas (pH ≥ 6,5). En otras condiciones, todas heces con pH ácido son patológicas. Un pH ≤ 5,5 sugiere presencia de azúcares reductores, a excepción de los polisacáridos que por lo general dan un pH ligeramente ácido. La medición de esta prueba tiene gran valor en el estudio de las diarreas agudas en niños menores de 5 años; en diarreas por bacterias invasivas el pH generalmente es alcalino, en diarreas de origen toxico es neutro y en las virales siempre es ácido. Este parámetro tiene valor, sólo si la muestra es llevada inmediatamente al laboratorio. Antes de realizar la prueba, se recomienda mezclar bien las heces y realizar la medición una vez que la muestra fecal llegue al laboratorio ya que el pH se modifica rápidamente. Manual de Coproanálisis para Asistentes de Laboratorio Clínico.. INCE Licdo: Pedro Félix Hernández Bello Carúpano: septiembre de 2005
- 19. EI pH de las heces se mide corrientemente con un simple papel tornasol o con papel indicador de pH que señala el pH aproximado Fundamento de la prueba: Papel tornasol: Se basa en un principio cualitativo colorimétrico, en el cual al poner en contacto las heces con el papel impregnado con un indicador, este varia de color dependiendo de la cantidad de hidrogeniones H + o de grupos oxhidrilos OH - . El papel tornasol viene en dos presentaciones: un papel de color rosado y otro de color azul (o violeta). Si el papel tornasol es azul, y cambia a rosado, la reacción es ácida, si es rosado y cambia a azul, la reacción es alcalina, si ambos papeles permanecen iguales, la reacción es neutra. . La cinta reactiva o papel indicador de pH (Merck, Macherey-Nagel, Paper- hidrion), tiene el mismo fundamento del papel tornasol, con la diferencia que éste presenta una escala colorímetrica, que mediante comparación, sirve para semicuantificar el pH. Técnica: Si las heces son líquidas, semilíquidas o blandas, ponemos en contacto la tira reactiva o el papel tornasol con la muestra, dentro del recolector,. Si las muestras son pastosas o duras, procedemos a realizar una suspensión de heces con agua destilada o solución salina fisiológica, (en un tubo de ensayo agregamos aprox. 0,2 ml de la solución y una pequeña porción de la muestra) e introducimos la tira reactiva y el papel tornasol. Una variante sería, que después de preparada la extensión a examinar, pongamos en contacto, por un costado de la preparación, la tira reactiva o el papel tornasol. Manual de Coproanálisis para Asistentes de Laboratorio Clínico.. INCE Licdo: Pedro Félix Hernández Bello Carúpano: septiembre de 2005
- 20. Reacción y patologías más frecuentes: Heces de reacción ácida: o Malabsorción de carbohidratos. o Malabsorción de grasas. o Deficiencia de disacaridasa. o Infección por rotavirus. o Sprue o Dispepsia fermentativa. Heces de reacción alcalina: o Colitis. o Insuficiencia gástrica. o Degradación de proteínas o Uso prolongado de antibióticos. o Infección por Proteus. PRESENCIA DE MOCO: La presencia de moco en una muestra fecal es anormal y debe reportarse. La mucosa del colon secreta moco como respuesta a un estímulo nervioso (parasimpático). MOCO TRANSPARENTE Y GELATINOSO: • Estreñimiento • Colitis. • Esfuerzo excesivo al defecar. • Alteraciones emocionales. MOCO CON SANGRE: • Neoplasias. • Inflamación del conducto anal. • Amibiasis aguda. MOCO CON PUS Y SANGRE: • Disentería bacilar. • Cáncer de colon. • Colitis ulcerativa. • Tuberculosis intestinal. Al extender la muestra debemos preferir la parte que tenga moco y / o sangre. PRESENCIA DE SANGRE: No es normal encontrar sangre en las heces. En algunas patologías podemos encontrarla en dos formas: Sangre fresca y Sangre Oculta. La sangre en las heces puede provenir de cualquier parte del tracto intestinal, desde la boca hasta el ano. La sangre fresca sugiere que la sangre proviene de la parte inferior del tracto gastrointestinal (intestino grueso y recto). Estas heces son rojas o de color marrón y a este proceso se le denomina HEMATOQUECIA. Manual de Coproanálisis para Asistentes de Laboratorio Clínico.. INCE Licdo: Pedro Félix Hernández Bello Carúpano: septiembre de 2005
- 21. Causas comunes de sangrado fresco: Hemorroides, fisuras anales, infección intestinal, inflamación intestinal, diverticulitis, tumor, pólipos o cáncer de colon, trauma o cuerpo extraño Las heces negras suelen indicar que la sangre proviene de la parte superior del tracto gastrointestinal que abarca el esófago, el estómago o la primera parte del intestino delgado. La razón es que la sangre al exponerse a los jugos digestivos adquiere un aspecto típico de alquitrán (petróleo). A estas heces negras se les denomina MELENA Causas comunes de sangrado del tracto G.I superior: Ulceras sangrantes en el estómago o el duodeno. (Abuso de aspirina, naproxeno, etc.).Gastritis, varices esofágicas, trauma o cuerpo extraño. PRUEBA DE SANGRE OCULTA: Para esta prueba el paciente debe abstenerse de ingerir carnes rojas, chorizos, morcillas, o vegetales con actividad de peroxidasa como por ejemplo los rábanos etc, durante por lo menos tres días antes del examen. Las muestras seriadas aumentan la exactitud del examen. En la práctica utilizamos dos métodos para determinar sangre oculta. Prueba del piramidón: Fundamento: Los compuestos derivados de la hemoglobina (grupo heme) catalizan la oxidación del piramidón, por el peróxido de hidrógeno. Materiales requeridos: Ácido acético al 20% Piramidón (Otros cromógenos que pueden utilizarse con esta técnica son: guayaco, bencidina, toluidina, tevenon-rolland etc.) Agua oxigenada (peróxido de hidrógeno) al 3% Técnica: 1.- Colocamos una porción de la muestra (aprox. 1 gramo) en un tubo de ensayo, le agregamos 3 gotas del ácido acético y mezclamos con un aplicador. (Esto es con la finalidad de hemolizar los hematíes que puedan estar presentes y liberar la hemoglobina) 2.- Añadimos 3 gotas del cromógeno y agitamos el tubo. (El cromógeno forma un complejo con la hemoglobina). 3.- Agregamos 3 gotas del agua oxigenada y movemos suavemente. Este peróxido actúa sobre el complejo formado, oxidándolo, produciendo una coloración violeta. Manual de Coproanálisis para Asistentes de Laboratorio Clínico.. INCE Licdo: Pedro Félix Hernández Bello Carúpano: septiembre de 2005
- 22. Hemoccult , Occultest , Hema-screen etc.. Son Kit comerciales cuyo principio es el mismo que el anterior, pero con la diferencia de ser más prácticos. Consiste en un papel de filtro impregnado con una sustancia orgánica (guayaco, bencidina, ortotoluidina etc…) al cual se le aplica una cantidad de la muestra a examinar y posteriormente por el lado contrario, se le añade una solución alcohólica de peróxido de hidrógeno (aprox 2 gotas). Cualquier coloración azul o violeta se considera positiva y la lectura debe realizarse inmediatamente porque en algunos casos la coloración tiende a desaparecer rápidamente. Si disponemos en el laboratorio de papel de filtro y piramidón, podemos sustituir la técnica en tubo de la siguiente manera: A.- Impregnamos el papel de filtro (puede ser una tira de aprox. 3 cm de largo x 1cm de ancho o un pedazo circular) con la solución de piramidón y esperamos que se seque (pueden guardarse para ser utilizada posteriormente) B.- Aplicamos muestra de un lado del papel de filtro, esperamos que se seque o incluso se puede esperar hasta el día siguiente. C.- Por el otro lado del papel de filtro, agregamos 1 ó 2 gotas de un revelador preparado de la siguiente manera: volúmenes iguales de alcohol absoluto y agua oxigenada al 3%, en caso de no contar con este reactivo, podemos agregar 2 gotas de ácido acético, esperamos 2 minutos y agregamos 2 gotas de agua oxigenada. Resultado: Cualquier coloración azul o violeta se considera positiva y la lectura debe realizarse inmediatamente porque en algunos casos la coloración tiende a desaparecer rápidamente. NO DEBEMOS REALIZAR LA PRUEBA CON LA TIRA REACTIVA PARA ORINA, YA QUE ESTA ES MUY SENSIBLE Y OBTENDREMOS FALSOS POSITIVOS. (LOS ENTEROCOCOS SON Manual de Coproanálisis para Asistentes de Laboratorio Clínico.. INCE Licdo: Pedro Félix Hernández Bello Carúpano: septiembre de 2005
- 23. PEROXIDASAS POSITIVOS) PRESENCIA DE GRASA: Las moléculas de grasa son una importante fuente de energía para el cuerpo. Los ácidos biliares producidos por el hígado disuelven las grasas en el contenido acuoso intestinal, permitiendo que las enzimas transformen sus grandes moléculas en otras más pequeñas como son los ácidos grasos y el colesterol. Los ácidos biliares se unen a estas moléculas mas pequeñas y las ayudan a pasar al interior de las células de la mucosa, donde vuelven a formar moléculas grandes, las cuales llegan a los vasos linfáticos cercanos al intestino, pasan a la sangre y son trasportadas hacia los lugares de depósitos en distintas partes del cuerpo. El aumento de grasa en las heces fecales se debe a: 1.- Malabsorción. (esprúe, rotavirus, giardiasis crónica etc..) 2.- Enteritis y patología pancreática con ausencia de lipasa (ejemplo: pancreatitis crónica) , Extirpación quirúrgica de una parte del intestino.. El exceso de grasa en la materia fecal se denomina Esteatorrea. Macroscópicamente, la materia fecal con grasa abundante, tiene un aspecto cremoso brillante. La evacuación típica es espumosa, grasosa (brillante), blanda y fétida Prueba del Sudán III: El Sudán III es un colorante soluble en grasa (liposoluble), y al ponerse en contacto con las mismas las colorea de rojo escarlata. Técnica: en lámina portaobjeto se agregan 2 o 3 gotas de la solución de Sudán III, con un aplicador colocamos una porción de muestra, mezclamos y colocamos una laminilla cubreobjetos. (Si calentamos la preparación, logramos una mejor coloración de las gotas de grasas) Interpretación de los resultados: En niños y adultos la presencia de 5 gotas o más por campo microscópico de 40X, se considera patológico. En niños lactantes es positivo con más de 20 gotas por campo microscópico, esto es debido a que ellos presentan un menor coeficiente de absorción de grasas. Para la determinación de las grasas fecales debemos tener en cuenta los falsos positivos: • Grasa proveniente de las manos del auxiliar. • Láminas o laminillas, mal lavadas o contaminadas con grasas. • Supositorios o cremas grasosas (vaselina) en el periné. • Ingesta de aceite Castor o aceite mineral. • Ingesta de mayonesa dietética baja en calorías. • Dieta con fibra abundante. • Solución de contraste radiográfico. No es adecuado realizar una sola muestra de materia fecal. Manual de Coproanálisis para Asistentes de Laboratorio Clínico.. INCE Licdo: Pedro Félix Hernández Bello Carúpano: septiembre de 2005
- 24. Confección de las preparaciones para el análisis microscópico directo: El análisis macroscópico debe ser minucioso, en busca de moco, pus, sangre o de otros elementos parasitarios, apreciables a simple vista, como son, los proglótides de Taenia, parásitos adultos como, Enterobius vermicularis, Trichuris trichiura, Dipylidium caninum. A cualquiera de estos elementos que se observen o se sospechen en la muestra, se les debe prestar mayor atención, puesto que muchas veces de este examen depende el diagnóstico. Entonces podemos decir que para un examen de heces, es MUY IMPORTANTE la interrelación Bioanalista-Asistente de Laboratorio. Si las heces están formadas (pastosas o duras), el examen microscópico del moco, o de moco y sangre que recubre el bolo fecal, nos permitirá encontrar trofozoítos de Entamoeba histolytica, ya que por lo general, en la masa fecal no se observan. Si estas heces formadas no presentan sangre, moco y/o pus, el material de elección a examinar, va a ser el procedente del raspado de la parte externa de la materia fecal. ¿Esto porqué? Porque los parásitos y/o sus huevos se encuentran en las paredes del tubo intestinal y la material fecal los va arrastrando y adhiriendo en su superficie . Si nos damos a la tarea de mezclar la muestra fecal formada, vamos diluyendo la posibilidad de encontrar estos elementos parasitarios. Cuando las heces no están formadas (blandas, semilíquidas, líquidas) estos elementos parasitarios pueden encontrarse ocultos en medio de la materia fecal, en este caso si debemos mezclar bien la muestra y proceder a confeccionar su preparación para posterior observación. (si se realiza por duplicado, ampliamos la posibilidad de encontrar elementos parasitarios) Materiales requeridos: A.- Material básico: Aplicador de madera (palillo). Lámina portaobjeto. Lámina cubreobjeto. B.- Solución diluente: Solución salina fisiológica. (SSF) Técnica: 1. En el centro de una lámina porta objeto bien limpia y desgrasada, se agrega una o dos gota de SSF. 2. Con un aplicador de madera tomamos una pequeña porción de materia fecal, de tamaño similar a un grano de arroz. 3. Homogeneizamos la muestra en la SSF y colocamos la lámina cubreobjeto. En un extendido bien hecho, si colocamos la preparación sobre papel periódico, podemos observar, las letras con claridad. En una preparación gruesa el número de elementos parasitarios es mayor que en las finas. En la preparación fina se observan mejor los protozoarios y sus quistes, así como huevos incoloros (Necator americanus) o ciertos huevos pequeños. Para el examen microscópico directo también pueden realizarse preparaciones coloreadas, como son: Lugol, Azul de metileno, Quensel.etc… La técnica es la misma que para el examen directo, pero cambiamos la solución diluente para cada caso. Confección de la preparación con lugol: Materiales requeridos Manual de Coproanálisis para Asistentes de Laboratorio Clínico.. INCE Licdo: Pedro Félix Hernández Bello Carúpano: septiembre de 2005
- 25. A.- Material básico B.- Solución diluente: Lugol. La solución de lugol podemos comprarla concentrada, lista para usar, o también podemos prepararla. Si la solución de lugol está en la presentación concentrada, podemos diluirla 1:5 con agua destilada.(1 volumen de Lugol y 4 volúmenes de agua destilada). Dobell y O’connor recomiendan una solución yodada débil, la cuál se prepara de la siguiente manera: Yoduro de potasio 2 gramos. Cristales de Yodo 1 gramo. Agua destilada csp 100 cc. Las preparaciones con lugol deben ser finas, para que en casos necesarios permita al Bioanalista utilizar el objetivo de inmersión. Con esta coloración se resaltan las características morfológicas pero tiene el inconveniente que los quistes y trofozoítos disminuyen sus tamaños, dificultándose un poco la observación. El lugol nos permite visualizar las inclusiones de glucógeno en los protozoarios, como es el caso de la Iodamoeba butschlii, además, la presencia de glucógeno en los quistes de Entamoeba histolytica nos indica su grado de madurez , también, podemos determinar la presencia de Almidón en la preparación por medio de esta coloración (ver Azucares Reductores) Confección de la preparación con Azul de metileno: Materiales requeridos: A.- Material básico B.- Solución diluente: azul de metileno al 0,5%, dejamos reposar aprox. 15 minutos y listo para observar. Esta coloración se utiliza para identificar polimorfonucleares Otra solución que sirve para identificar a los polimorfonucleares, es el ácido acético al 20%, (el mismo utilizado en la prueba de sangre oculta) debido a que en solución ácida, los núcleos de los polimorfonucleares resaltan. Ambas soluciones tienen la desventaja que no podemos diferenciar que tipo de polimorfonucleares son. Los polimorfonucleares son indicativos de disentería bacilar y/o procesos inflamatorios. Es muy frecuente el reporte de amibiasis en heces con abundantes polimorfonucleares, esto es completamente erróneo, en la amibiasis no se observan polimorfonucleares; debido a que la Entamoeba histolytica, los fagocita. El término amibiasis es exclusivo de la infección gastrointestinal producida por la Entamoeba histolytica, no se le asigna a la infección causada por otras amibas. En caso de observar abundantes polimorfonucleares y trofozoítos que sugieran Entamoeba histolytica, pudiera tratarse de Entamoeba dispar u otra amiba, los exámenes serológicos serían los mas adecuados para la identificación del protozoario. Confección de la preparación con Quensel: Materiales requeridos: A.- Material básico B.- Solución diluente: colorante de Quensel. La preparación se deja reposar aprox. 15 minutos y listo para observar. Es una buena coloración para diferenciar protozoarios, ya que permite que las características del núcleo se observen muy bien y se puede utilizar el objetivo de inmersión (100X) Desventaja: El BIOANALISTA poco experimentado puede confundir los núcleos de los polimorfonucleares con núcleos parasitarios. Confección de la preparación para la técnica de GRAHAM. La visualización de E. vermicularis o sus huevos, en el examen rutinario de heces, es bastante Manual de Coproanálisis para Asistentes de Laboratorio Clínico.. INCE Licdo: Pedro Félix Hernández Bello Carúpano: septiembre de 2005
- 26. difícil, por lo tanto se recomienda en aquellos pacientes que presentan , prurito anal (sobre todo a los niños), realizar la técnica de GRAHAM (cinta adhesiva transparente). Para la toma de la muestra , se debe orientar al paciente, al familiar o al representante, debido a la incomodidad que representa la misma. FUNDAMENT O La hembra de Enterobius vermicularis deposita sus huevos en las márgenes del ano durante la noche. La técnica de Graham tiene por objeto adherir estos huevos a la cinta adhesiva transparente o cinta “scotch”, la que se extenderá posteriormente en una lámina portaobjeto para su observación microscópica. MATERIALES Láminas portaobjetos desengrasadas. Cinta adhesiva transparente o cinta “scotch” de 1 pulgada de ancho, Aplicador (bajalengua). PROCEDIMIENTO Extendemos la cinta adhesiva transparente sobre la superficie de la lámina portaobjeto, adhiriendo una porción pequeña a ambos extremos, dejando una lengüeta, separamos la cinta de la lámina portaobjeto cuando se va a tomar la muestra La obtención de la muestra debe realizarse en la noche, 2 a 3 horas después que el paciente (generalmente niños) están dormidos, o a la mañana siguiente y sin que se haya realizado el aseo de la región perianal. El paciente debe estar inclinado exponiendo la región glútea, se despega la cinta adhesiva levantando la lengüeta hasta que quede expuesta la parte adherente y, con ayuda del bajalengua, se aplica el lado adhesivo. Adherimos la cinta haciendo toques en la región perianal en sentido horario o antihorario Terminada la aplicación, extendemos la cinta adhesiva y la volvemos a pegar en la lámina portaobjeto, la envolvemos con el papel y colocamos el nombre del paciente. Lista para llevar al laboratorio a ser analizada por el Bioanalista. RESULTADO Se pueden observar huevos y/o adultos de E.vermicularis. y en ocasiones, se pueden observar al microscopio, huevos de otros helmintos, principalmente huevos de Taenia sp., Ascaris lumbricoides, Trichuris trichiura entre otros. Exámenes por fijación y coloración de Frotis Recuento diferencial: Los leucocitos están presentes en las heces en enfermedades intestinales inflamatorias, esto puede ser el resultado de una enfermedad diarreica aguda bacteriana o parasitaria El recuento diferencial debe realizarse a aquellas muestras que tengan un número elevado de leucocitos y se hace con la finalidad, de investigar la etiología del proceso que está ocurriendo. Si observamos mayor porcentaje de Segmentados Neutrófilos, orienta a un proceso inflamatorio, que puede ser bacteriano. Si el recuento está a favor de Eosinófilos, orienta a alergia intestinal, que puede ser producida por ciertos parásitos, hongos, medicamentos, enfermedades inmunológicas etc.. Si predominan Manual de Coproanálisis para Asistentes de Laboratorio Clínico.. INCE Licdo: Pedro Félix Hernández Bello Carúpano: septiembre de 2005
- 27. los Mononucleares, por lo general, la cantidad de leucocitos en la muestra está disminuida, debido a que es un proceso crónico, como es el caso de Tuberculosis (TBC) intestinal, Salmonelosis (Salmonella tiphy) o en amibiasis aguda y/o crónicas. Materiales requerido: A.- Material Básico B.- Suero, plasma Solución albuminosa diluida C.- Colorante de Giemsa. (Diluido 1/51; 5 ml de buffer o agua destilada y 0,1 ml de Giemsa.) Técnica: 1.- En el centro de una lámina porta objeto bien limpio y desgrasada, agregamos una o dos gotas de suero, plasma ó solución albuminosa diluida. 2.- Con un aplicador de madera tomamos una pequeña porción de materia fecal (preferiblemente la parte que contiene moco o el moco mismo), 3.- Homogeneizamos la muestra y la extendemos o realizamos un frotis circular como para realizar un frotis de secreción uretral o una gota gruesa. 4.- Esperamos que se seque. 5.- Fijamos con metanol. 6.- Coloreamos con la solución de Giemsa x 10min. Lavamos con agua. 7.- listo para suministrar al Bionalista para que proceda a su observación. El suero, plasma o solución albuminosa se utilizan, porque permiten que la preparación se fije mejor y no se pierda en el proceso de lavado. El colorante de Giemsa se prepara a esa dilución, ya que mas concentrado, los leucocitos se colorean muy intensamente, (depende del pH de la muestra) impidiendo a veces su diferenciación. Hematoxilina Férrica de Heidenhain Colorea protozoarios, principalmente amebas y flagelados. En caso de que no se pueda llegar a un diagnóstico correcto de la (o las) especies de protozoarios presentes en la preparación, o tengamos duda al respecto, debemos proceder a la coloración con hematoxilina férrica. Es una excelente coloración, pero es costoso y poco práctico, lo que limita su uso en los laboratorios de rutina. MATERIALES Y REACTIVOS: - Láminas portaobjetos y cubreobjetos, Frasco coplin o placas Petri, Estilete o pinza curva, Colorante de hematoxilina, Cytoseal o bálsamo de Canadá, Alcoholes 50%, 70%, 85%, 95% y absoluto en placas petri., Solución Schaudinn, Solución mordiente de sulfato de fierro y amonio, Tintura de yodo, Solución fisiológica, Manual de Coproanálisis para Asistentes de Laboratorio Clínico.. INCE Licdo: Pedro Félix Hernández Bello Carúpano: septiembre de 2005
- 28. . Procedimiento. - Preparamos un set de placas petri 100 x 150 mm o el frasco Coplin con los reactivos correspondientes, y con ayuda de un estilete o pinza curva hacemos un frotis fino en la lámina o la laminilla, esta última sujeta al porta-laminilla. - Si la muestra es dura, hacemos una emulsión previa en solución fisiológica, realizamos el frotis y pasamos por solución de Schaudinn durante 3 a 5 minutos. - Pasamos por alcohol 70% más 1 a 2 gotas de tintura de yodo por 5 minutos. - Pasamos por alcohol 70% y 50% de 5 a 10 minutos cada vez. - Pasamos por agua corriente por 5 a 10 minutos. - Pasamos por la solución mordiente 2% de 5 a 10 minutos y enjuagar con agua corriente. - Pasamos por colorante por 5 a 10 minutos (1 mL de solución colorante hematoxilina y 9 mL de agua). - Lavamos con agua y pasamos por una segunda solución de mordiente al 2% para decolorar, observando la intensidad de la coloración. - Lavamos con agua corriente a chorro continuo de 10 a 15 minutos. - Deshidratamos pasando por alcohol 70%, 85%, 95% y absoluto, de 10 a 15 minutos cada uno. - Aclaramos con xilol agitando el frotis, montamos con cytoseal o bálsamo de Canadá. - Facilitamos la preparación al Bioanalista para que proceda a su observación RESULTADOS:. El citoplasma de los parásitos se observan de color azul oscuro y los núcleos de color morado intenso a negruzco. Bk en heces: Un BK en heces se realiza, en caso de que el personal médico sospeche de TBC intestinal, o cuando se quiere diferenciar entre levaduras y Cryptosporidium spp. Podemos realizar esta prueba, por medio de dos tipos de coloraciones: A.- Coloración en caliente: Ziehl-Nielsen. B.- Coloración en frío: Kinyoun. En ambas coloraciones, el bacilo tuberculoso y el Cryptosporidium spp por ser ácido alcohol resistente se colorean de rosados. Materiales requeridos para la coloración de Ziehl-Nielsen: A.- Material Básico B.- Kit para coloración de Ziehl-Nielsen. C.- Mechero, encendedor o cualquier instrumento que proporcione llama directa. Kit para coloración de Ziehl-Nielsen, está compuesto por: 1.- Colorante de Ziehl-Nielsen Fuscina básica 1 Gr Ácido Fénico (fenol) 5 Gr Alcohol absoluto al 95% 10 ml Agua destilada csp.100 ml 2.- Alcohol Ácido. HCl 3 ml Alcohol absoluto al 95% 97 ml 3.- Azul de metileno. al 1 % Manual de Coproanálisis para Asistentes de Laboratorio Clínico.. INCE Licdo: Pedro Félix Hernández Bello Carúpano: septiembre de 2005
- 29. Técnica con la coloración de Ziehl-Nielsen: (Coloración en caliente) 1.- con un aplicador de madera tomamos una pequeña porción de materia fecal, de tamaño similar a un grano de arroz, y la colocamos en el centro de una lámina porta objeto bien limpio y desgrasado. 2.- Extendemos o realizamos un frotis circular como para realizar un frotis de secreción uretral o una gota gruesa. 3.- Esperamos que se seque o calentamos ligeramente para que se fije la preparación. 4.- Cubrimos la preparación con el reactivo de Ziehl-Nielsen durante 5min. aprox. y calentamos ligeramente, hasta que la lámina emita vapores sin llegar a hervir (unas tres veces). 5.- Lavamos con agua. 6.- Decoloramos con el alcohol ácido. (No debemos estipular un tiempo de decoloración, sino mas bien observar hasta que la preparación pierda la mayor cantidad de colorante posible). 7.- Lavamos con agua 8,- Agregamos el azul de metileno x 1min. 9.- Lavamos con agua y esperamos que se seque. 10. listo para observar Materiales requeridos para la coloración de Kinyoun: A.- Material Básico B.- Kit para coloración de Kinyoun. El Kit para coloración de Kinyoun, está compuesto por: 1.- Colorante de Kinyoun. Fuscina básica 4 Gr Ácido Fénico (fenol) 8 Gr Alcohol absoluto al 95% 20 ml Agua destilada csp.100 ml 2.- Alcohol Ácido. HCl 3 ml Alcohol absoluto al 95% 97 ml 3.- Azul de metileno. al 1 % Manual de Coproanálisis para Asistentes de Laboratorio Clínico.. INCE Licdo: Pedro Félix Hernández Bello Carúpano: septiembre de 2005
- 30. Técnica con la coloración de Kinyoun: (Coloración en frío) 1.- Con un aplicador de madera tomamos una pequeña porción de materia fecal, de tamaño similar a un grano de arroz, y la colocamos en el centro de una lámina porta objeto bien limpio y desgrasado. 2.- Extendemos o realizamos un frotis circular como para realizar un frotis de secreción uretral o una gota gruesa. 3.- Esperamos que se seque o calentamos ligeramente para que se fije la preparación. 4.- Cubrimos la preparación con el colorante de Kinyoun, esperamos de 3 a 5min. 5.- Lavamos con agua. 6.- Decoloramos con el alcohol ácido. (No debemos estipular un tiempo de decoloración, sino mas bien observar hasta que la preparación pierda la mayor cantidad de colorante posible). 7.- Lavamos con agua 8,- Agregamos el azul de metileno x 1min. 9.- Lavamos con agua y esperamos que se seque. 10. listo para observar La coloración de Kinyoun es más práctica, debido a que es una coloración en frío y eliminamos el paso de calentamiento. Ambas dan excelentes resultados. Si detallamos la constitución de los dos colorantes, podemos notar que son los mismos, solo que para el Kinyoun están en mayor concentración. Coloración de Gram: Una tinción de Gram. es un método para teñir microorganismos (bacterias) utilizando una serie especial de colorantes. En la práctica esta coloración ha permitido la separación de los microorganismos en dos grandes grupos de acuerdo con su comportamiento respecto a los colorantes que en ella intervienen , designándose Gram positivos a los que retienen la Violeta de Genciana (color morado) y como Gram negativos a los que se colorean con la Safranina o colorante de contraste (color rosado). Este examen se puede realizar para tratar de diagnosticar una infección o enfermedad, que algunas veces involucra diarrea; y dependiendo si es Gram positivo o negativo, el médico administrará el antibiótico adecuado Para este examen, se tiñe una muestra de heces y luego se examina bajo el microscopio. Este método se puede aplicar a casi cualquier muestra clínica y es una de las técnicas más comúnmente utilizadas para el diagnóstico rápido de infecciones bacterianas. Materiales requerido: A.- Material Básico C.- Kit de coloración de Gram. El Kit para coloración de Gram. , está compuesto por: Manual de Coproanálisis para Asistentes de Laboratorio Clínico.. INCE Licdo: Pedro Félix Hernández Bello Carúpano: septiembre de 2005
- 31. 1.- Violeta de Genciana (cristal violeta).al 1% 2.- Lugol. (Yodo). 3.- Alcohol acetona. (73 ml de alcohol absoluto + 27 ml de acetona) 4.- Safranina. (Solución muy diluida) Técnica: 1.- Con un aplicador de madera tomamos una pequeña porción de materia fecal, de tamaño similar a un grano de arroz, y la colocamos en el centro de una lámina porta objeto bien limpio y desgrasado. 2.- Extendemos o realizamos un frotis circular. Esperamos que se seque. 3.- Cubrimos la preparación con Violeta de genciana, durante 1min. 4.- Lavamos con agua. 5.- Agregamos el Lugol x 1min. 6.- Lavamos con agua. 7.- Decoloramos con el Alcohol-Acetona (No debemos estipular un tiempo de decoloración, sino mas bien observar hasta que la preparación pierda la mayor cantidad de colorante posible). 8.- Lavamos con agua. 9.- Agregamos la Safranina muy diluida x 30min. 10.- Esperamos que se seque y lista para observar. Cultivo de materia fecal, Cultivo de heces o Coprocultivo: Es un examen de laboratorio que se utiliza para aislar e identificar organismos en las heces que puedan causar síntomas y enfermedad gastrointestinal. Normalmente, muchos organismos están presentes en las heces, pero algunos pueden actuar como patógenos (organismos causantes de enfermedades). Algunas bacterias causan síntomas debido a las toxinas que producen, mientras que otras causan síntomas por efectos bacteriales directos. Este examen se realiza cuando se presenta algún problema gastrointestinal y se sospecha que la causa puede ser una infección. Se puede realizar si se presenta diarrea severa, persistente o recurrente sin causa aparente. También se puede realizar cuando se ha estado sometido por largo tiempo a una terapia con antibióticos para observar si bacterias como la C. difficile, que normalmente no habita en el intestino, se encuentra en la muestra. Esta prueba es muy importante porque además de identificar al Manual de Coproanálisis para Asistentes de Laboratorio Clínico.. INCE Licdo: Pedro Félix Hernández Bello Carúpano: septiembre de 2005
- 32. microorganismo responsable del proceso infeccioso, permite sugerirle al médico, el antibiótico de elección a utilizar. Condiciones para el Coprocultivo No tomar antibióticos por lo menos 48 horas antes de la recolección Recolección y procesamiento: Ver “Recolección de la muestra” 1.- Se utiliza un envase recolector para recoger la muestra de heces, el cual se devuelve al laboratorio lo antes posible (preferiblemente recolectar la muestra en el Laboratorio). La muestra no deberá contener papel higiénico, orina ni otro contaminante. 2.-Algunos laboratorios suministran al paciente un medio de transporte. En este caso, se debe mezclar bien las heces con un hisopo estéril y con el hisopo impregnado colocar la muestra, con el moco (si lo hubiere), en el medio proporcionado 3.- Si después de la recolección, transcurre más de 30min. Es preferible sellar muy bien el recolector, (si es posible envolverlo en plástico) e introducirlo en un recipiente con hielo para posteriormente llevarlo al Laboratorio. 4.-Al ser recibida e identificada la muestra, se coloca una porción en un ambiente de cultivo para estimular el crecimiento de microorganismos. Se observa el crecimiento del cultivo en el laboratorio a intervalos regulares. Cuando se observa que ha habido crecimiento el Bioanalista recurre a una serie de procedimientos para lograr identificar al (o los) microorganismo. Además realiza otras pruebas para determinar la sensibilidad del microorganismo identificado a ciertos antibióticos. MÉTODOS DE CONCENTRACIÓN Los trofozoítos, quistes, ooquistes, larvas y huevos, pueden concentrarse por diversos procedimientos, lo cual permite corroborar el hallazgo del método directo y conocer la intensidad del enteroparasitismo. Estos procedimientos de concentración pueden ser: flotación, sedimentación, o por combinación de ambos métodos. La elección de cada procedimiento dependerá de las facilidades del laboratorio, el adiestramiento del personal, la procedencia de la muestra (zona geográfica), el conocimiento de la prevalencia de los parásitos (zona costeña, andina y selvática o área rural o urbana), y la especie del parásito que se desea investigar. I.- Métodos de concentración por sedimentación sin centrifugación. A.-Técnica de la sedimentación espontánea en tubo Fundamento. Se basa en la gravidez que presentan todas las formas parasitarias para sedimentar espontáneamente en un medio menos denso y adecuado como la solución fisiológica. En este método es posible la detección de quistes, trofozoítos de protozoarios, huevos y larvas de helmintos. MATERIALES Y REACTIVOS: - Tubos de vidrio o plástico de 13 x 100, 16 x 150, o tubos de 50 mL de capacidad que terminen en forma cónica. Láminas portaobjetos, Laminillas de celofán recortadas adecuadamente (22 x 22 mm ó 22 x 30 mm.), Solución fisiológica, Pipetas de vidrio o plástico, Agua destilada, Gasa recortada en piezas de 9 x 9 cm. Procedimiento. 1- Tomamos una porción de heces (1 - 2 g) y homogeneizamos con solución fisiológica en un tubo limpio o en el mismo recipiente en que se encuentra la muestra. 2- Colocamos una gasa, hundiéndola en la abertura del tubo y sujetándola con una liga alrededor de ella 3- Filtramos el homogeneizado a través de la gasa, llenando el tubo hasta la cuarta parte de su Manual de Coproanálisis para Asistentes de Laboratorio Clínico.. INCE Licdo: Pedro Félix Hernández Bello Carúpano: septiembre de 2005
- 33. contenido. 4- Agregamos solución fisiológica hasta 1 cm por debajo del borde del tubo. 5- Tapamos la abertura del tubo con un tapón, parafilm o celofán. 6- Agitamos enérgicamente el tubo por 15 segundos aproximadamente. 7- Dejamos en reposo de 30 a 45 minutos. En caso que el sobrenadante esté muy turbio, lo eliminamos y repetimos la misma operación con solución fisiológica o agua. 8- Aspiramos la parte media del tubo con una pipeta y colocamos 1 ó 2 gotas en una lámina portaobjeto. 9- Aspiramos el fondo del sedimento con una pipeta y depositamos 1 ó 2 gotas del aspirado en los extremos de la otra lámina portaobjeto. 10- Cubrimos ambas preparaciones con las laminillas cubreobjetos . 11- Agregamos 1 ó 2 gotas de solución lugol a una de las preparaciones. 12- Facilitamos la preparación al Bioanalista para su observación RESULTADOS: Podemos observar formas móviles y de menor peso específico (trofozoítos, quistes y larvas) y en la preparación con lugol podemos observar las estructuras internas, de estos y de otros parásitos de mayor peso específico (huevos, larvas). B.-Método de sedimentación rápida (TSR, MSR) (Lumbreras y col. 1962): Fundamento. Se basa en la gravidez de los huevos que, por su tamaño y peso sedimentan rápidamente cuando se suspenden en agua. MATERIALES Y REACTIVOS: Copa o vaso de vidrio o plástico, cónico , Colador de malla metálica o plástico, laminas, laminillas, Aplicador de madera (1/3 de bajalengua). Solución de Lavado: Agua filtrada , destilada o SSF Procedimiento 1- Homogeneizamos 3 a 6 g de heces con unos 10 a 20 mL de Solución de lavado 2- Colocamos el colador y dos capas de gasa en la abertura del vaso y a través de ella, filtramos la muestra. 3- Retiramos el colador y llenamos la copa con solución de lavado hasta 1 cm. debajo del borde, Manual de Coproanálisis para Asistentes de Laboratorio Clínico.. INCE Licdo: Pedro Félix Hernández Bello Carúpano: septiembre de 2005
- 34. esto es 15 a 20 veces el volumen de la muestra. Dejamos sedimentar la muestra durante 30 minutos. Decantamos las 2/3 partes del contenido del vaso y agregamos nuevamente solución de lavado agua. Repetimos los pasos anteriores cada 5 a 10 minutos por 3 a 4 veces, hasta que el sobrenadante quede limpio. 4- Transferimos 1 o dos gotas del sedimento a una lámina portaobjetos con ayuda de una pipeta Pasteur o de un gotero y proporcionamos el preparado al Bioanalista para su observación. RESULTADOS: Observar la presencia de huevos. Este método es especialmente útil para la búsqueda de Fasciola hepatica, Paragonimus sp. y nematodos como Ascaris lumbricoides (huevo fecundo o infecundo), Trichuris trichiura, Hymenolepis nana, Diphyllobothrium etc. II.- Centrifugación con agua o solución salina fisiológica Este es un método de concentración por centrifugación MATERIALES Y REACTIVOS: Agua o Solución salina fisiológica, Gasa, Embudo, Tubo de centrifuga, láminas porta y cubreobjetos. TECNICA: 1.- Mezclamos 1 a 2 gr. de heces con 10 a 20 veces su volumen de agua o SSF, la mezcla se pasa a través de una gasa doble o de un colador de malla fina, colocado sobre un embudo, recogiendo el producto del filtrado en uno o dos tubos de centrífuga 2.- Centrifugamos los tubos a 2.500 rpm durante 3 a 5 minutos. 3.- Decantamos el líquido que sobre nada y colocamos una porción del sedimento entre cubre y portaobjeto. 4.- Listo para ser observado por el Bioanalista Manual de Coproanálisis para Asistentes de Laboratorio Clínico.. INCE Licdo: Pedro Félix Hernández Bello Carúpano: septiembre de 2005
- 35. RESULTADO: Con este método se enriquecen los quistes de protozoarios, los huevos de Fasciola hepática e infecundos de Ascaris lumbricoides .Utilizando solución salina isotónica de cloruro de sodio los trofozoítos de amiba se concentran en estado vivo de 15 a 40 veces. III.- Métodos de Charles y Barthelemy. Es un método de concentración por centrifugación MATERIALES Y REACTIVOS: Gasa, Embudo, Tubo de centrifuga, Solución salina fisiológica formolada al 10 %, solución cítrica formolada, Éter, láminas porta y cubreobjetos. Preparación de: SSF formolada al 10 % Solución salina fisiológica 90 cc. formol 10 cc. Solución cítrica formolada Ácido cítrico 120 gr Formol 20 cc. Agua destilada c.s.p..100 cc 1.- Colocamos en un tubo de ensayo unos 15 cc de solución fisiológica formolada al 10 % con aprox. dos gramos de material fecal y mezclamos bien, hasta que el material quede totalmente diluido. 2.- Filtramos a través de un trozo de gasa doblada en cuatro partes, colocada en un embudo de vidrio y recogemos el filtrado en un tubo de centrifugación. Centrifugamos durante 5 minutos a 1.800 rpm. Decantamos el líquido sobrenadante 3.- Diluimos el sedimento en el mismo tubo con 15 cc. de solución cítrica formolada y agregamos 2 a 3 cc. de éter. Agitamos el tubo vigorosamente y centrifugamos durante 2 a 3 minutos. Las grasas disueltas por el éter, los detritus vegetales y fecaloides más livianos, se acumulan en la superficie formando un tapón, que debemos descartar. Centrifugamos de nuevo durante 2 a 3 minutos. Se forma en el tubo otro tapón superficial, por debajo del cual hay una capa de líquido y en el fondo un pequeño sedimento que habrá que examinar. 4.- Descartamos el líquido sobrenadante y el tapón y colocamos unas gotas del sedimento entre Manual de Coproanálisis para Asistentes de Laboratorio Clínico.. INCE Licdo: Pedro Félix Hernández Bello Carúpano: septiembre de 2005
- 36. porta y cubreobjeto para que el Bioanalista proceda a su examen microscópico. NOTA: Da buenos resultados para huevos de helmintos Y quistes de protozoarios. IV.- Método de Teleman – Rivas. Es un método de concentración por centrifugación con éter. MATERIALES Y REACTIVOS: Ácido Acético al 5% , Gasa, Tubo de centrifuga, Éter, láminas porta y cubreobjetos. TECNICA: l.- Colocamos aproximadamente 1 ó 2 gramos de heces en un tubo de ensayo Agregamos 5 cc. de una soluci6n de ácido acético al 5% ( pudiendo ser HCl al 5%, 10 cc). Tapamos la boca del tubo con un tapón y agitamos enérgicamente hasta homogeneizar lo más posible su contenido. 2.- Dejamos reposar la dilución durante 5 minutos para que se sedimenten las partículas más gruesas y el líquido que sobrenada se filtra a traves de dos capas de gasa fina, recogiendo el producto del filtrado en un tubo de centrífuga. 3. -Agregamos un volumen igual de éter, puede ser éter sulfúrico, agitamos para emulsionar bien y centrifugamos durante 2 a 3 minutos. La masa se reparte en 4 partes distintas: a) Hacia arriba el éter que ha disuelto las grasas Y materiales colorantes. b) Por debajo una capa gruesa formada por finos detritus fecales. c) Una capa liquida ácida y coloreada d) El depósito del sedimento que contiene partes pesadas restos de vegetales quistes de protozoarios, huevos de helmintos Decantamos las tres capas superiores, quedando el sedimento, en el fondo del tubo de centrífuga, de donde retiramos una porción que colocamos entre porta y cubreobjeto, par ser examinada por el Bioanalista. Puede colocarse con Lugol etc. Manual de Coproanálisis para Asistentes de Laboratorio Clínico.. INCE Licdo: Pedro Félix Hernández Bello Carúpano: septiembre de 2005
- 37. RESULTADO: Este método enriquece bastante los huevos de helmintos. Tiene el inconveniente que desfigura los quistes de protozoarios V.- Método de Willis - Malloy. Es un método de concentración por flotación con solución salina sobresaturada . MATERIALES Y REACTIVOS: colador o Gasa, embudo, recipiente cilíndrico, láminas porta y cubreobjetos y solución salina saturada preparada de la siguiente manera: Sal común 31, 5 grs Agua destilada 89 ml TÉCNICA: 1. -En un tubo de ensayo mezclamos 1 gramo de heces con 10 a 20 volúmenes de solución saturada de cloruro de sodio, homogeneizándola lo más completamente posible. 2-pasamos la mezcla a través de un colador o gasa doblada colocado sobre un embudo, para separar las partículas grasas, y el: líquido filtrado se recoge en un recipiente que debe ser cilíndrico y de un diámetro de 2,5 cms. para que pueda ser recubierta totalmente por el porta o cubre objeto, añadimos solución saturada de cloruro de sodio hasta llenar completamente el recipiente y formar un menisco. 3.- dejamos reposar la mezcla por espacio de 30 minutos, colocamos un cubreobjeto sobre la superficie del menisco, hasta que el material acumulado en el mismo se adhiera a la cara del cubre-objeta. Depositamos el cubreobjetos. 4.- Listo para que el Bioanalista proceda a examinar NOTA: si realizamos esta prueba en un vaso de poca altura podemos reducir el tiempo de reposo. Por ejemplo, si utilizamos el mismo recolector (después de realizar el examen directo) reduciríamos el tiempo en apenas 5 min. Manual de Coproanálisis para Asistentes de Laboratorio Clínico.. INCE Licdo: Pedro Félix Hernández Bello Carúpano: septiembre de 2005
- 38. VI.- Método de Parodi y Alcaraz. (Método de concentración por flotación sin centrifugación, en solución sobresaturada de azúcar): Fundamento. Se basa en la propiedad que tienen los quistes y/o huevos de flotar en la superficie de una solución saturada de azúcar, debido a su menor densidad. El método es útil para la detección de quistes de protozoarios y huevos de helmintos MATERIALES Y REACTIVOS: Agua, Gasa, Tubo de ensayo, Solución azucarada de Parody y Alcaraz, láminas porta y cubreobjetos, bajalengua o palillos. Preparación original de la solución azucarada de Parody y Alcaraz Azúcar 900 gr. Agua 1.100 cc. Ácido acético 10 cc. Fenol 10 cc. Actualmente, se ha modificado, el fenol se ha sustituido por formol, no se le agrega ácido acético y el azúcar utilizado es el azúcar morena (prieta o también llamada rubia) Manual de Coproanálisis para Asistentes de Laboratorio Clínico.. INCE Licdo: Pedro Félix Hernández Bello Carúpano: septiembre de 2005
- 39. TÉCN1CA: 1.- Colocamos 1 gr. de materia fecal en un tubo de ensayo que contenga 10 a 15 cc. de solución azucarada; tapamos el tubo y agitamos fuertemente durante uno a dos minutos. 2.- Pasamos este líquido a través de gasa fina doblada varias veces y recogemos el líquido filtrado en pequeños recipientes, más o menos de 15 cc. de capacidad. 3.- Agregamos la mezcla de fenol-azucarada hasta alcanzar los bordes del recipiente y dejamos en reposo durante 20 a 30 minutos 4.- Colocamos un cubre-objetos sobre la superficie líquida. Retiramos el cubre que lleva adheridas algunas gotas del líquido y lo colocamos sobre un porta-objeto. 5.- Listo para que el Bioanalista proceda a examinar.(se le puede agregar una gota de lugol a la preparación) VII. Método de Sheather Sugar: (Método de concentración por flotación con centrifugación en una solución de azúcar) Fundamento. Se basa en la flotación de quistes, ooquistes y huevos de parásitos en una solución de azúcar que posee mayor densidad que ellos. Esta técnica es útil para la concentración de quistes y ooquistes de protozoos y huevos de helmintos y se usa como método preferencial en el diagnóstico de los coccidios: Cryptosporidium, Cyclospora, Isospora, etc. MATERIALES Y REACTIVOS: Tubos de ensayo 13 x 100, Láminas portaobjetos y cubreobjetos, Aplicadores, Solución saturada de azúcar, Asa de platino o pipetas Pasteur, Suero fisiológico, Embudo de vidrio, Gasa. Procedimiento. 1- Homogeneizamos 1 a 2 g de materia fecal en Solución salina fisiológica. 2- Colocamos un embudo de vidrio con una gasa doblada en la abertura del tubo de ensayo y filtramos el material homogeneizado. 3- Centrifugamos el tubo con el material homogeneizado a 1 500 rpm. durante 2 a 5 minutos. 4- Eliminamos el sobrenadante, y agregamos la solución de azúcar hasta 1 cm. del borde del tubo, agitando hasta disolver el sedimento, centrifugamos como en el paso anterior, completamos con la solución de azúcar hasta el borde y esperamos de 2 a 5 minutos . 5- Con la ayuda de un asa de platino o de una pipeta de Pasteur, tomamos una muestra de la superficie del menisco y la colocamos en una lámina portaobjeto, (también podemos colocar la laminilla o la lámina sobre el menisco) cubrimos con una laminilla. 6- Facilitar la preparación al Bioanalista para su observación. (Podemos agregar lugol) Manual de Coproanálisis para Asistentes de Laboratorio Clínico.. INCE Licdo: Pedro Félix Hernández Bello Carúpano: septiembre de 2005
- 40. RESULTADOS: Esta técnica es apropiada para la observación y registro de ooquistes de Isospora, Cryptosporidium, Cyclospora y Sarcocystis. En el caso de observar coccidios, de la superficie del preparado, tomar una muestra para preparar un frotis para teñir por el método de Ziehl-Neelsen modificado. VIII.- Método de Ritchie. Método de sedimentación por centrifugación y flotación (mixto, con fijador) Fundamento: Se basa en la concentración de los quistes y huevos por sedimentación mediante la centrifugación, con la ayuda de formol y éter para separar y visualizar los elementos parasitarios MATERIALES Y REACTIVOS: Agua, Gasa, Tubo de centrífuga, formol al 7,5%, éter, láminas porta y cubreobjetos, bajalengua o palillos, pipetas. ...TECNICA: 1.- Mezclamos la porción de heces con 10 volúmenes de agua. 2.- Pasamos la mezcla a través de un colador usando de 2 a 4 capas de gasa fina, recogiendo el producto del filtrado en un tubo de centrífuga de 15 mL. 3.- Centrifugamos por un minuto a 2.000 rpm., y decantamos el sobrenadante. 4.-Lavamos el sedimento con agua. 5.- Repetimos la centrifugación y el lavado. 6.- Decantamos el líquido sobrenadante. . 7.- Agregamos al sedimento 10 mI de una solución de formol al 7,5 %. 8.- Dejamos reposar durante 20 a 30 minutos. 9. -Agregamos cerca de 3 mI de éter, tapamos el tubo y agitamos vigorosamente con el cuidado respectivo. 10. Centrifugamos a 1500 rpm durante 1 minuto. 11.-Limpiamos los detritus superficiales de la pared del tubo, con un aplicador. 12.-Decantamos la mezcla sobrenadante. 13.-Listo para ser observado por el Bioanalista. Puede colocarse Lugol u otro colorante. Manual de Coproanálisis para Asistentes de Laboratorio Clínico.. INCE Licdo: Pedro Félix Hernández Bello Carúpano: septiembre de 2005
- 41. IX.- Método de Faust. Método de sedimentación y flotación por centrifugación con sulfato de zinc al 33,3% y densidad 1180: Fundamento Se basa en que los quistes y/o huevos de los parásitos flotan en la superficie por ser de menor densidad que el sulfato de zinc a 33,3%, cuya densidad es 1180. Es útil para la búsqueda de quistes y/o huevos de parásitos y excepcionalmente se observan larvas. Se recomienda controlar la densidad del sulfato de zinc y usar agua filtrada para el lavado previo de la muestra. MATERIALES Y REACTIVOS: Agua, Gasa, Tubo de centrífuga, solución de ZnS04 al 33%., láminas porta y cubreobjetos. TECNICA: 1.- Colocamos aprox. 3 gr. de heces en un tubo de ensayo y agregamos 10 ml de agua: homogeneizamos. 2.- Tamizamos con 4 dobleces de gasa, exprimiendo la gasa con dos palillos. Centrifugamos por 1 minuto a 1.000 r.p.m. 3.- Decantamos el líquido sobrenadante y agregamos 5 ml de agua y mezclamos con un palillo. Completamos con agua hasta la cantidad que fue eliminada, centrifugamos por un minuto y repetimos este paso hasta obtener un sobrenadante claro. 4.- Decantamos este sobrenadante claro y lo reemplazamos con ZnSO4 al 33%., mezclamos el sedimento con la solución y centrifugamos por un minuto. 5.-No decantamos , pasamos un asa, pipeta o colocamos una laminilla sobre la superficie del menisco (exactamente igual a como lo hicimos en el método de Willis-Malloy). 6.- Listo para ser observado por el Bioanalista y si el lo desea, se le puede añadir una gota de lugol, la cual es conveniente para los quistes de protozoarios. RESULTADOS: este es el método de concentración preferido para Giardia lamblia X. Método de observación por aclaramiento o KATO: Fundamento. Método que consiste en la diafanización o aclaración de las heces con el uso de glicerina, que permite preparar una capa transparente y observar las formas parasitarias. MATERIALES Y REACTIVOS: Láminas portaobjeto, Aplicador, Papel celofán (humectante especial), cortado de 2 x 3 cm y sumergidos en una solución de glicerina por un período no menor de 24 horas. Malla metálica o de nylon Solución glicerinada con verde de malaquita. Manual de Coproanálisis para Asistentes de Laboratorio Clínico.. INCE Licdo: Pedro Félix Hernández Bello Carúpano: septiembre de 2005
- 42. Preparación de la solución de KATO. GLICERINA 125,0 cc AGUA DESTILADA 112,5 cc. VERDE DE MALAQUITA (3%) 1,5 cc. AGUA DESTILADA 11,0 cc. PROCEDIMIENTO 1- Tamizamos 1 g de la muestra de heces a través de la malla metálica o nylon fino 2- Extendemos el tamizado sobre la lámina portaobjeto y cubrimos con una laminilla de papel celofán impregnada en la solución de Kato. 3- Comprimimos la muestra con un tapón, u otro objeto sobre la laminilla, secamos el exceso de glicerina. 4- Dejamos reposar por 30 minutos 5- Proporcionamos el preparado al Bioanalista, para que proceda a su observación. PROCEDIMIENTO ALTERNATIVO: (más comúnmente usado) 1.- Colocamos una porción de heces (mayor cantidad que para un examen directo) sobre la lámina portaobjetos. 2.- Sobre esta porción colocamos una laminilla de papel celofán impregnada en la solución de Kato, y comprimimos con un objeto, preferiblemente de borde plano, tratando de extender la muestra de manera uniforme. 3-.- Dejamos reposar por 30 min y preferiblemente al calor de una lámpara o bombilla. 4- Proporcionamos el preparado al Bioanalista, para que proceda a su observación. NOTA: En caso de que no tengamos el papel celofán, podemos sustituirlo por una laminilla cubreobjeto, mezclando las heces con solución de KATO. En ambos casos, debemos realizar el procedimiento sobre papel absorbente, con la finalidad de secar el exceso de solución . RESULTADO: Es una técnica apropiada para la observación de huevos de helmintos, larvas, ciertos parásitos adultos y algunos protozoarios como Isospora belli . XI. Método de Baermann (Método de concentración por migración) Fundamento Se basa en los tropismos positivos: geotropismo, termotropismo e hidrotropismo de los trofozoítos de protozoos y larvas de helmintos. Es útil principalmente para Balantidium coli y larvas de Strongyloides stercoralis. Manual de Coproanálisis para Asistentes de Laboratorio Clínico.. INCE Licdo: Pedro Félix Hernández Bello Carúpano: septiembre de 2005
- 43. MATERIALES Y REACTIVOS: - Copas cónicas de 200 a 300 mL., colador, pipetas, gasa, láminas cavadas, suero fisiológico Procedimiento 1- Colocamos la coladera o rejilla metálica con la gasa doblada (2 a 3 capas) dentro de la copa 2- Sobre la gasa agregamos, 4 a 6 g de la muestra de heces en fresco. 3-Vertemos solución salina a 37ºC en cantidad suficiente por el borde de la copa. 4- Dejamos a temperatura ambiente o en estufa a 28ºC - 37C de 30 a 50 minutos. 5- Sacamos la coladera o rejilla y con ayuda de una pipeta Pasteur obtenemos 1 mL de sedimento. 6- Colocamos el sedimento en una luna de reloj o lámina cavada. 7- Facilitamos la preparación al Bioanalista para su observación. RESULTADOS. Se pueden observar trofozoítos y larvas en movimiento. En algunas ocasiones se pueden observar formas adultas de E. vermicularis macho. INFECCIONES VÍRICAS GASTROINTESTINALES Las gastroenteritis agudas se encuentran entre las enfermedades más frecuentes del ser humano, solamente superadas por las infecciones víricas respiratorias agudas. Los principales virus productores de gastroenteritis en el ser humano son los rotavirus, adenovirus, calicivirus, astrovirus y. Otros virus, tales como los coronavirus, torovirus, picobirnavirus y picornavirus (virus Aichi) son tambiéncausa de diarrea, pero con menor trascendencia epidemiológica . Virus productores de gastroenteritis en la especie humana Rotavirus (grupos A, B, C) Adenovirus entéricos (serotipos 40 y 41) Calicivirus: virus tipo Norwalk (NLV) y tipo Sapporo (SLV) Astrovirus Coronavirus-like Torovirus virus Aichi (Picornaviridae) Picobirnavirus Rotavirus (diarrea) La infección por rotavirus es la causa más común de diarrea grave en bebés y niños. El agente etiológico Los rotavirus del grupo A constituyen la principal causa de gastroenteritis grave en niños de todo el mundo. Producen unos 125 millones de infecciones cada año en los países en desarrollo y son causa de 873.000 fallecimientos anuales. . Es sumamente contagioso, y la mayoría de los niños se infectan Manual de Coproanálisis para Asistentes de Laboratorio Clínico.. INCE Licdo: Pedro Félix Hernández Bello Carúpano: septiembre de 2005